Fluorescentie en Fosforescentie

Wat is fluorescentie?
Als we dit opzoeken op bijvoorbeeld wikipedia (https://nl.wikipedia.org/wiki/Fluorescentie), dan vinden we de volgende omschrijving:
“Fluorescentie is een bijzonder geval van luminescentie. Het is een natuurkundig verschijnsel waarbij een elektron een hoogenergetisch foton absorbeert en daardoor in een aangeslagen toestand belandt en vervolgens terugvalt naar de grondtoestand onder uitzending van een foton van lagere energie (langere golflengte).
Het begrip fluorescentie is afkomstig van fluoriet: een mineraal dat bestaat uit het zout calciumfluoride (CaF2), een bekende fluorescerende stof.”
Dit klinkt allemaal best wel ingewikkeld. Ik zal proberen het wat nader uitleggen:
Alle materie om ons heen is opgebouwd uit atomen. Bekende atomen zijn bijvoorbeeld:
- Zuurstof ( O )
- Waterstof ( H )
Als atomen samen worden gevoegd dan ontstaan er moleculen, bijvoorbeeld:
- Zuurstof ( O2 ) . Opvallend is dat hier dezelfde benaming wordt gebruikt als bij het atoom zuurstof. Eigenlijk is de O2 die wij inademen di-zuurstof, ook wel moleculaire zuurstof genoemd. Bij O2 zijn dus 2 O atomen aan elkaar verbonden
- Water ( H2O ). Hierbij zijn er 2 H atomen verbonden aan 1 O atoom
Atomen zelf bestaan uit de kern (die weer bestaat uit protonen en neutronen) en om deze kern heen draaien elektronen. En om deze elektronen draait het nu precies bij fluorescentie.
Hieronder een afbeelding van een zuurstofatoom:

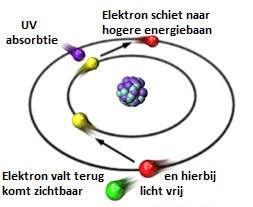
In het midden van het atoom zit de atoomkern, om deze kern heen draaien de elektronen.
Deze elektronen draaien in een soort balans om de atoomkern heen. Deze balans kan in sommige gevallen verstoord worden door bijvoorbeeld UV-licht.
Als er op de elektronen de energie van UV-licht (licht bestaat uit fotonen, hoe kort golviger het licht, hoe meer energie deze bevat) wordt losgelaten, dan kunnen sommige elektronen uit hun balans worden geschoten naar een hogere baan waar ook andere elektronen zitten.
Deze toestand is niet houdbaar omdat de balans verstoord is en het elektron zal weer terugspringen naar zijn originele toestand. Tijdens dit terugspringen komt er energie vrij in de vorm van licht.
Hieronder wordt dit schematisch weergegeven:
Lichtspectrum
Het licht dat wij kunnen zien is van heel diep rood tot diep paars. Dit is het spectrum van licht dat wij dus kunnen waarnemen. Hieronder wordt dat weergegeven in de volgende twee overzichten:

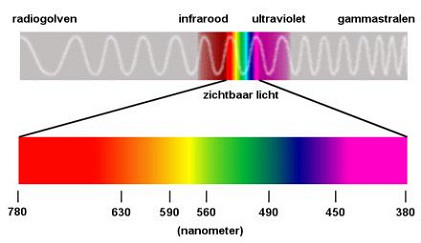
Zoals te zien is zit er voor rood, infrarood en na paars / violet komt ultraviolet. Hoe korter de golflengte, hoe meer energie deze bevat
Ultraviolet licht
Bij golflengten kleiner dan 400 nanometer spreken we van ultraviolet licht. Dit gebied kan nog verder worden onderverdeeld in UV-A, UV-B en UV-C-straling
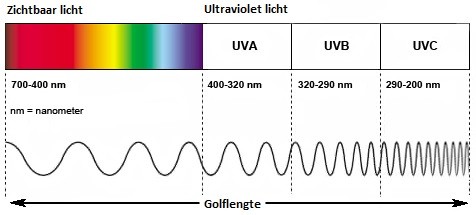
Bij fluorescerende mineralen maken we over het algemeen ook onderscheid tussen UV-A, UV-B en UV-C actieve mineralen. Er is een groot aantal mineralen die fluoresceren onder invloed van UV-A licht. Bekende voorbeelden hiervan zijn Robijn en Fluoriet.
Daarnaast zijn er zeer veel mineralen die fluoresceren onder UV-C licht. Dit is wat minder bekend omdat hier speciale lampen met speciale filters voor nodig zijn om dit te kunnen waarnemen.
Veel van deze mineralen fluoresceren ook onder UV-B licht, soms is het effect ook in een andere kleur.
Dit alles is ook het mooie aan fluorescerende mineralen. De diversiteit in de verschillende fluorescenties zijn zeer groot en alle kleuren van de regenboog komen voor bij fluorescerende mineralen
